Calor especifico agua liquida
Calor específico del aire
La capacidad calorífica específica es la cantidad de calor necesaria para elevar un gramo de un material un grado centígrado (oC).[2] Se expresa en julios por gramo y por grado centígrado ([math]\frac{J}{g\times ^oC}[/math]), y viene dada por la ecuación:[3]
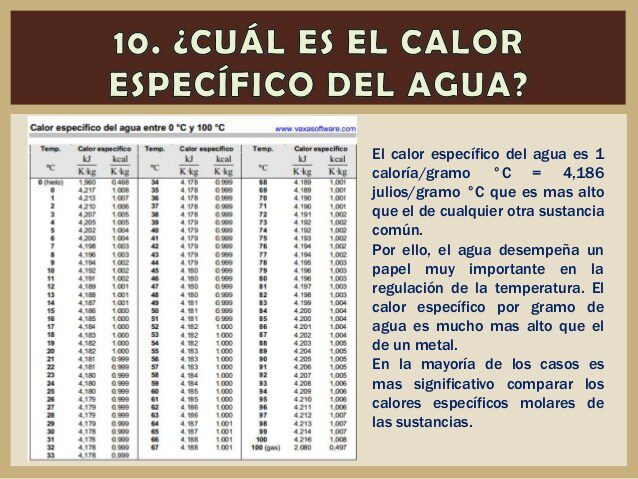
El calor específico del agua es [math]c=4,186 \frac{J}{g\times ^oC}[/math], que da la definición de la caloría, y es relativamente alto comparado con otras sustancias comunes. Por ello, el agua desempeña un papel muy importante en la regulación de la temperatura[3].
La tercera ley de la termodinámica muestra que, a medida que un objeto se acerca al cero absoluto, su capacidad calorífica específica es cada vez mayor, con la consecuencia de que, aunque las sustancias pueden acercarse mucho a esta temperatura, nada la alcanzará nunca[4].
Capacidad calorífica específica del hielo
Los materiales varían en su capacidad de almacenar energía térmica. Por ejemplo, un material como el cobre se calentará mucho más rápido que el agua o la madera. El calor específico es una medida de la energía necesaria para calentar 1 gramo de sustancia a 1º C. El calor específico se registra en «calorías» para la «masa en gramos» (y en «julios para el kg»).
La figura 7.11 compara el calor específico de varios metales con el calor específico del hielo, el agua y el vapor. Se necesita mucha más energía para calentar el agua que otros materiales, incluidos el hielo y el vapor. Debido a la alta capacidad de calor específico del agua, los océanos son capaces de almacenar grandes cantidades de energía procedente del calentamiento solar. El calor absorbido en las regiones ecuatoriales puede ser transportado a largas distancias y llevado por las corrientes oceánicas antes de ser liberado en las regiones polares.
Cuando cualquier material se calienta hasta la temperatura en la que cambia de estado (convirtiéndose de sólido a líquido, o de líquido a gas), la temperatura permanecerá igual hasta que todo el material cambie de estado. Como se necesita más energía para convertir una sustancia de un estado físico a otro (de sólido a líquido, o de líquido a gas), esas transiciones requieren una mayor cantidad de energía. El calor latente es el calor necesario (medido en calorías quemadas) para convertir un sólido en líquido o vapor, o un líquido en vapor, sin que haya un cambio de temperatura. Por ejemplo, una olla llena de agua en la estufa se calentará gradualmente hasta que la temperatura del agua se acerque a los 212° F (o 100° C); permanecerá a esa temperatura hasta que toda el agua haya hervido. Lo mismo ocurre cuando el agua se congela. A medida que el agua se enfríe, alcanzará los 32°F (o 0° C) y permanecerá a esa temperatura hasta que toda el agua se congele (Figura 7.12).
Unidad de calor específico
En termodinámica, la capacidad calorífica específica (símbolo cp) de una sustancia es la capacidad calorífica de una muestra de la sustancia dividida por la masa de la muestra. El calor específico también se denomina a veces capacidad calorífica másica. Informalmente, es la cantidad de calor que debe añadirse a una unidad de masa de la sustancia para provocar un aumento de una unidad de temperatura. La unidad del SI de la capacidad calorífica específica es el julio por kelvin por kilogramo, J⋅kg-1⋅K-1.[1] Por ejemplo, el calor necesario para elevar la temperatura de 1 kg de agua en 1 K es de 4184 julios, por lo que la capacidad calorífica específica del agua es de 4184 J⋅kg-1⋅K-1.[2]
La capacidad calorífica específica suele variar con la temperatura y es diferente para cada estado de la materia. El agua líquida tiene una de las mayores capacidades caloríficas específicas entre las sustancias comunes, unos 4184 J⋅kg-1⋅K-1 a 20 °C; pero la del hielo, justo por debajo de 0 °C, es de sólo 2093 J⋅kg-1⋅K-1. Las capacidades caloríficas del hierro, el granito y el hidrógeno gaseoso son de unos 449 J⋅kg-1⋅K-1, 790 J⋅kg-1⋅K-1 y 14300 J⋅kg-1⋅K-1, respectivamente[3] Mientras la sustancia está en transición de fase, como la fusión o la ebullición, su capacidad calorífica específica es técnicamente infinita, porque el calor se destina a cambiar su estado en lugar de aumentar su temperatura.
Cp del agua
La capacidad calorífica específica es la cantidad de calor necesaria para elevar un gramo de un material un grado centígrado (oC).[2] Se expresa en julios por gramo y por grado centígrado ([math]\frac{J}{g\times ^oC}[/math]), y viene dada por la ecuación:[3]
El calor específico del agua es [math]c=4,186 \frac{J}{g\times ^oC}[/math], que da la definición de la caloría, y es relativamente alto en comparación con otras sustancias comunes. Por ello, el agua desempeña un papel muy importante en la regulación de la temperatura[3].
La tercera ley de la termodinámica muestra que, a medida que un objeto se acerca al cero absoluto, su capacidad calorífica específica es cada vez mayor, con la consecuencia de que, aunque las sustancias pueden acercarse mucho a esta temperatura, nada la alcanzará nunca[4].